老批件換證須知!這八類保健食品需要補做功能試驗
2024-11-26
2023年8月31日,國家市場監管總局發布的公告(《允許保健食品聲稱的保健功能目錄 非營養素補充劑(2023年版)》及其配套文件),標志著“雙無”保健食品的清理換證政策已正式確定,過渡期為5年。
2024年11月1日,國家市場監督管理總局發布了《在產在售“無有效期和無產品技術要求”保健食品集中換證審查要點》的公告,對“雙無”保健食品換證的具體操作進行了詳細說明,為地方監管部門和企業提供了指導,以確保換證工作順利開展。
過渡期內,對于在產在售的“雙無”國產產品,注冊人按照要求提出換證申請;對于在產在售“雙無”進口產品,相關材料符合本審查要點規定的,注冊人按照要求直接提出換證申請,審評機構根據換證審查需要,可以組織開展境外現場核查。
注冊人按照本審查要點規定準備換證材料,按照變更注冊程序向市場監管總局申請換證,變更注冊類別為“雙無”換證。省級市場監管部門應當根據產品實際生產的技術要求和監管情況,依據現行法律法規提出產品換證意見,報送市場監管總局,并抄送注冊人。
其中八類產品,功能學試驗評價依據為原衛生部發布《保健食品功能學評價程序和檢驗方法(1996版)》的,需重新開展的功能學試驗項目如下表:
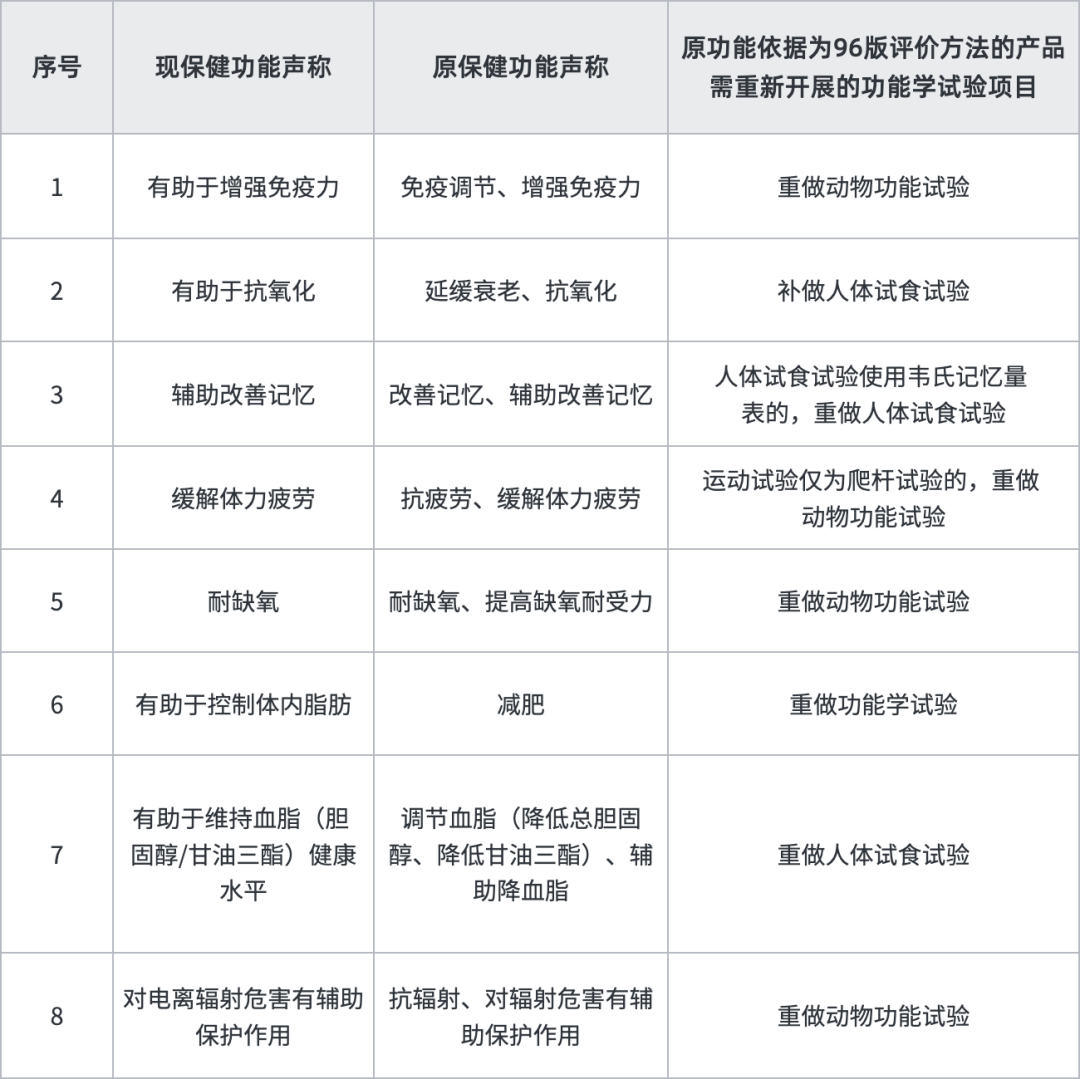
補做功能試驗的依據為《保健食品功能檢驗與評價技術指導原則(2023年版)》《保健食品功能檢驗與評價方法(2023年版)》《保健食品人群試食試驗倫理審查工作指導原則(2023年版)》。
很多企業比較關心換證費用和周期,這需要根據每個產品不同情況做出具體分析,費用少則免費,多則幾十萬,周期少則幾個月,多則三四年。近幾年我們已幫助一些先行的企業進行換證相關工作,以變更事項遞交,獲得寶貴的審評意見和經驗,歡迎企業與我們交流,我們會對換證產品進行全面評估和分析,提供經濟、可行、保障的換證方案,依法合規、穩步推進,從而確保5年內順利換證!
